君实生物,医药明星股,国内研制新冠抗体的企业之一。
11月12日,因某自媒体的一篇微信公众号文章,君实生物盘中股价急速下挫,随后收到了上交所火速下发的问询函。
君实生物A股13日低开低走,盘中震荡走低,截至收盘,该股报71.27元下跌6.22%,成交5.27亿元。至此,该股最近两个交易日跌约10%。值得注意的是,君实生物上市当日股价最高至220.4元,市值曾超千亿,但随后一路下挫,13日盘中最低下探至67.5元,区间跌幅达67%。
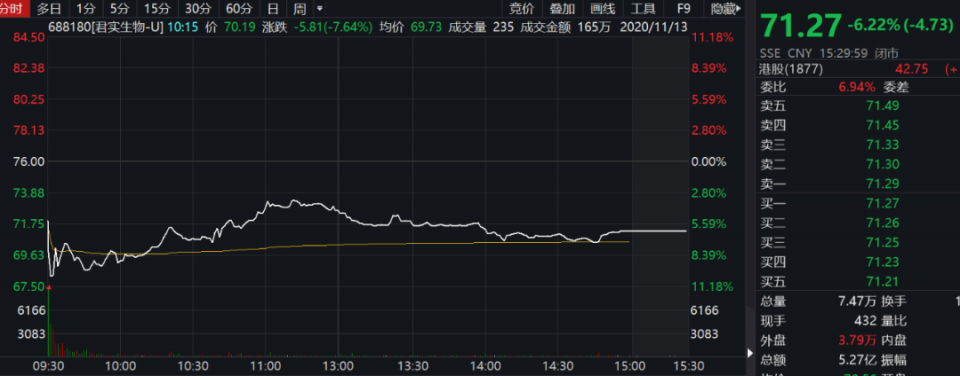
君实生物A股13日走势 来源:Wind
不过,君实生物H股13日震荡收涨1.30%。
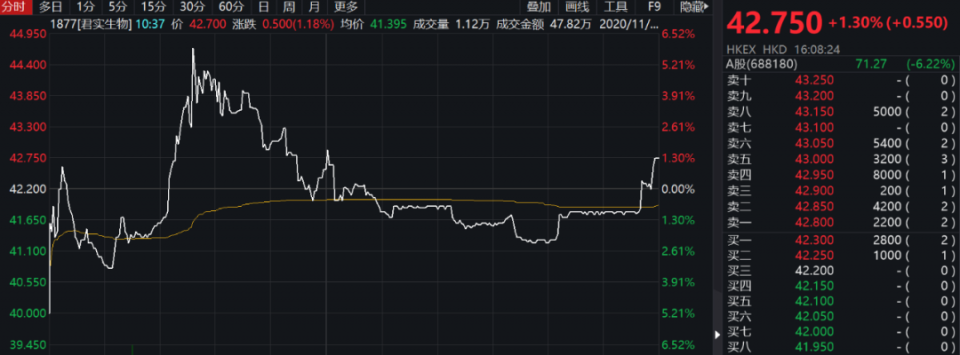
君实生物H股,来源:Wind
11月13日晚,君实生物发布关于问询函的回复公告表示,经确认,公司认为有关媒体报道中关于公司及有关人士的报道内容全面失实,与客观事实严重不符、相悖。据中国证券报报道,君实生物已对相关自媒体寄出律师函。

君实生物回应四大质疑
公告全文超9000字,主要会回应了四方面的质疑。
一、不良反应发生率为何高达97.7%?
君实生物称,相关媒体提到的“97.7%的所有不良反应发生率”来自于特瑞普利单抗说明书的“HMO-JS001-II-CRP-01”研究,是一项开放、多中心、单臂、II 期临床研究,入组既往接受全身系统治疗失败后的不可手术或转移性黑色素瘤患者,共纳入128例患者,其定义为:研究中,所有研究者判断为“肯定相关”、“很可能相关”、“可能相关”及“可能无关”和“无法判定”的所有级别的不良事件。
“HMO-JS001-II-CRP-01”研究不良反应主要包括如皮疹、乏力、食欲下降、恶心、咳嗽、头晕等1-2级(轻微)不良反应,3-4级不良反应发生率非常低。
二、前9月专利许可收入为2.09亿元
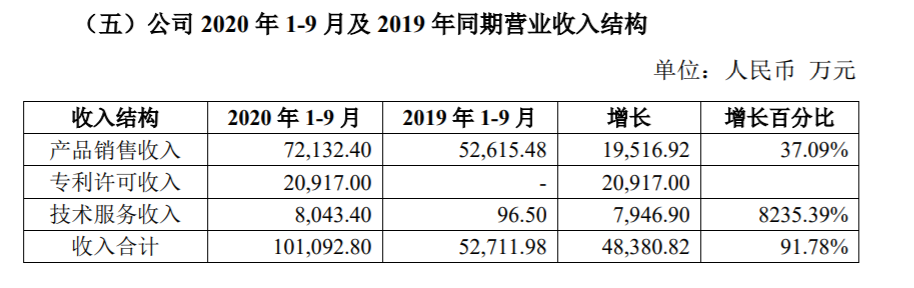
公告显示,公司2020年1-9月公司营业收入较2019年1-9月增加4.84亿元,同比增长91.78%。其中:产品销售收入较去年同期增加1.95亿元,同比增长 37.09%。
专利许可收入较去年同期增加2.09亿元,均为公司与礼来制药合作新冠中和抗体项目许可收入,其中:首付款1000万美元,里程碑收入2000万美元。
营业收入的增长也带动了公司应收账款的增加,截至2020年9月30日公司应收账款余额为4.02亿元,较去年同期增加2.39亿元,其中:应收礼来制药 1.45亿元,其余应收账款的增加均来自于特瑞普利单抗销售增长,该部分款项预期均能在账期内正常回款。
三、公司与礼来制药未就股权投资签订认购合同
根据公司此前披露的公告,公司将其产品JS016在大中华地区外开展研发活动、生产和销售的独占许可授予礼来制药,礼来制药将向公司支付现金、销售分成;礼来制药可能会按照双方同意的条款和条件,以7500万美元认购公司新发行的H股股份。
公司认为,在医药公司的商业合作中,为加深双方的合作意愿及长远的共同利益,结合技术转让/授权与股权投资进行深化合作,是比较常见的合作模式之一。在公司与礼来制药的上述合作中,除落实了技术转让/授权外,双方经公平协商,同意进一步开展协商礼来制药对公司进行股权投资的合作。截至本回复公告日,公司与礼来制药未就前述股权投资签订任何具有法律约束力的股份认购合同。
四、研发力量究竟如何?
君实生物表示,截至2020年11月12日,公司全体员工中,本科及以上学历的员工数量为1630人,占员工总人数的70.08%,其中博士45人,硕士370人。在公司现任董事、高级管理人员中,7名拥有博士学位,NING LI(李宁)、张卓兵、SHENG YAO(姚盛)、冯辉、GANG WANG(王刚)等均参与公司的相关研发工作。
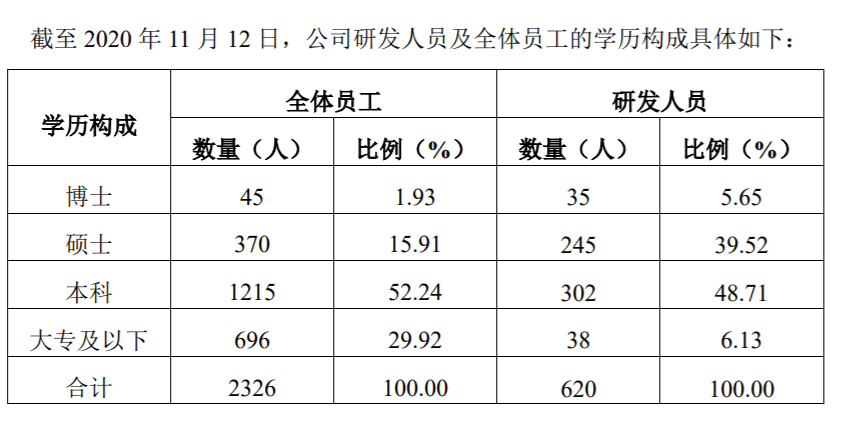
公司目前的研发人员中,有38人为大专学历,这些员工大多从事研究工作的配合和支持工作,暂未直接参与核心的研发活动。参考同行业科创板上市公司公开信息,大专学历的研发人员占研发人员总数的比例大多在10%-15%。
君实生物CEO李宁回应质疑:
公司PD-1单抗一线临床口碑“同类最佳”
另外,每日经济新闻(微信号:nbdnews)记者了解到,君实生物董事长熊俊、CEO李宁以及相关核心研发人员等于11月13日上午参加了由国盛证券组织的电话会。李宁在会上表示,公司PD-1单抗在一线的临床使用中口碑“同类最佳”。
“经过公司核查,自媒体的报道全面失实,同公司的情况不相符。”李宁开场便表态称。
微信公众号的文章主要质疑君实生物核心产品PD-1特瑞普利单抗(拓益)存在问题,并认为公司在研发团队、与礼来的中和抗体(JS016)合作等方面存在问题。
特瑞普利单抗是君实生物自主研发的中国首个成功上市的国产PD-1单抗,获批适应症为既往标准治疗失败后的局部进展或转移性黑色素瘤。

图片来源:摄图网(图文无关)
李宁表示,相对已经上市的产品,公司的PD-1产品在一线的临床使用中建立了一定的口碑,根据公司的调研结果来看,在安全性、有效性上,可以说是“同类最佳”;从联合用药的角度来看,公司产品的可靠性和可预测性在临床研究上有很大优势;此外,公司持相对开放的心理,希望能够同创新药的合作伙伴一起合作,为病人找到更多的治疗路径。对于合作对手,公司也是经过了严格的筛选。
熊俊强调称,公司的PD-1单抗不止是临床实际应用中获得了好的口碑,在一些进行中的临床试验中对比一些已经获得适应症的上市药物,公司的PD-1单抗也呈现出了更好的潜在疗效的趋势,“对公司PD-1单抗的信心也是驱动其他研发方同公司合作的重要因素,有更好的疗效、安全的药物配对,临床试验的成功率会大增。”
缘何选择君实生物合作?
礼来称基于调研与数据
今年3月,君实生物宣布开始研发新冠病毒抗体药品,代号JS016。5月,君实生物和跨国制药巨头礼来宣布,双方已达成协议,将针对由SARS-CoV-2新型冠状病毒引起的新冠肺炎,共同开发潜在的预防与治疗性抗体疗法。礼来还被授予在部分地区对JS016开展研发活动、生产和销售的独占许可。对此,微信公众号的文章中称礼来已经终止了新冠抗体研究。君实生物同礼来的“555+JS016”的联合用药似乎出师未捷身先死。
对于同礼来的合作情况,李宁表示,站在公司的角度,公司同礼来签署的协议处于正常进行中,总的合作方向没有变化。公司承担的JS016原料药的生产任务也在按时按点的进行。其同时称,盖茨基金会同礼来签署的供药协议包括了君实生物和礼来的“555”,但协议的最终采购量尚不明确。
11月13日,礼来方面向每日经济新闻(微信号:nbdnews)记者表示,之所以选择君实作为合作伙伴,科学与数据是首要的原因。
兴业证券研报显示,中和抗体具有预防与治疗的双重作用,有望成为新冠“特效药”。目前全球共有12个中和抗体项目进入临床。其中就包括礼来和加拿大AbCellera公司联合开发的中和抗体LY-CoV555。目前,LY-CoV555已进入以预防为目的的III期临床试验阶段,以及进入以治疗为目的的临床试验阶段。
而国内公司中,君实生物和中科院微生物所合作开发的JS016则成为中国第一个、全球第二个进入临床试验的新冠病毒中和抗体疗法。
2020年6月,JS016在中、美两国启动临床试验,在中国的临床试验由复旦大学附属华山医院张菁教授与张文宏教授联合主持。不久前的进博会上,礼来方面还曾向包括《每日经济新闻》在内的媒体表示,目前JS016在中、美等国的临床试验已进入II期阶段,6月7日完成首例受试者给药,7月7日完成全部剂量组给药,目前I期临床试验已顺利完成。研究数据显示,JS016的安全性和耐受性良好。
10月7日,君实生物发布公告:礼来制药预计将于2020年11月提交LY-CoV555与JS016联合疗法的紧急使用授权(EUA)申请,礼来制药预期最早于2021年第2季度取得数据并提交联合疗法的生物制品许可申请(BLA)。
目前,礼来有两款新冠中和抗体,即上文提到的LY-CoV555和JS016。不过,目前礼来暂停了LY-CoV555联合瑞德西韦针对重症新冠住院患者的临床试验,但LY-CoV555单药用于治疗轻中度新冠状肺炎患者被美国FDA授权。
为何中止LY-CoV555与瑞德西韦联合用药临床试验?
11月13日,礼来方面回应每日经济新闻(微信号:nbdnews)记者时解释:对于新冠肺炎危重症患者,抗体疗法在此时收效甚微。由于感染时间长、症状重,患者已经产生内源性抗体,除了要控制抗体以外,患者可能已有其他的炎性反应和多器官衰竭发生,此时再去用药,无法控制其他症状。
来源:每日经济新闻
